发布日期:2025-12-19

近日,由中国食品药品检定研究院、首都医科大学附属北京地坛医院、清华大学等多家单位联合在《Virology Journal》期刊发表重要研究成果。研究以新冠病毒为基础,通过β-丙内酯(BPL)灭活处理,结合多实验室联合定值,成功建立基于数字PCR(dPCR)技术的新冠病毒抗原与核酸通用标准品,首次实现了抗原快速检测与核酸扩增检测LoD性能的直接跨方法比较,为新冠检测试剂的性能评估提供了“统一标尺”,也为其他病毒检测试剂的性能评价提供了参考。
新冠诊断中,抗原快速检测因快速、低成本广泛应用,核酸扩增检测因高灵敏度被视为“金标准”,但两大检测体系长期面临三大痛点:
抗原定量无标准:核酸可通过“拷贝数”精准定量,而抗原缺乏公认的标准化单位,导致抗原检测的分析性能(尤其是LoD)难以精准评估;
检测方法难对比:不同灭活方法(加热、γ辐射、BPL等)和病毒滴度单位(PFU/mL、TCID50/mL等)不统一,抗原快速检测与核酸扩增检测的灵敏度无法直接比较;
标准缺失影响决策:早期新冠疫情期间,WHO尚未建立抗原国际标准,且临床中抗原结果与核酸载量的关联需进一步验证,影响试剂选型和公共卫生策略制定。
建立基于数字PCR的新冠病毒抗原和核酸通用标准品,解决抗原定量无统一单位的问题;
优化灭活方法(加热 vs. BPL灭活),明确其对核酸检测和抗原活性的影响;
验证该标准品在抗原快速检测和核酸扩增检测LoD评估中的适用性,实现两种检测方法的灵敏度跨方法对比。
研究方法
采集10例新冠感染者不同感染时间咽拭子,用2种抗原试剂盒(免疫层析法)和5种核酸试剂盒(dPCR、qPCR、等温扩增等)检测。
对新冠毒株培养物用不同方法灭活,通过dPCR、qPCR、测序等分析影响,制备标准品候选物并冻干。
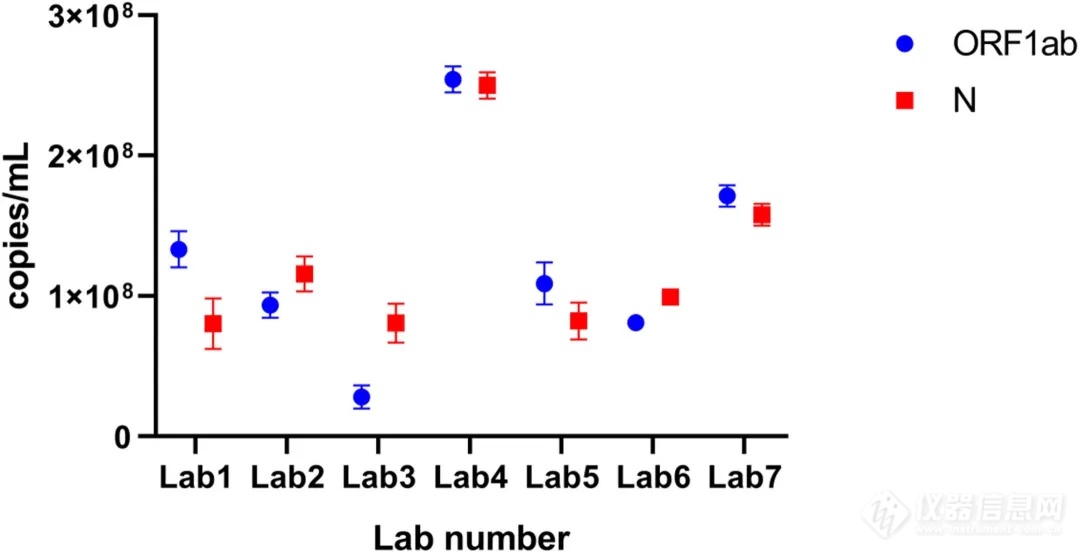
7家实验室用5种dPCR平台定值,评估7种抗原与7种核酸试剂盒LoD,SPSS统计分析(P<0.05有意义)。
研究结果
4种核酸试剂盒一致性好,等温微流控芯片法试剂盒E灵敏度较低;抗原试剂盒G优于F,抗原结果与核酸滴度存在显著相关性,为标准建立的“抗原和核酸关联逻辑”提供临床依据。
BPL灭活对核酸和抗原检测影响更小,优于热灭活,解决了“灭活影响抗原检测准确性”的难题。BPL灭活样本在dPCR、qPCR和测序中表现无影响。
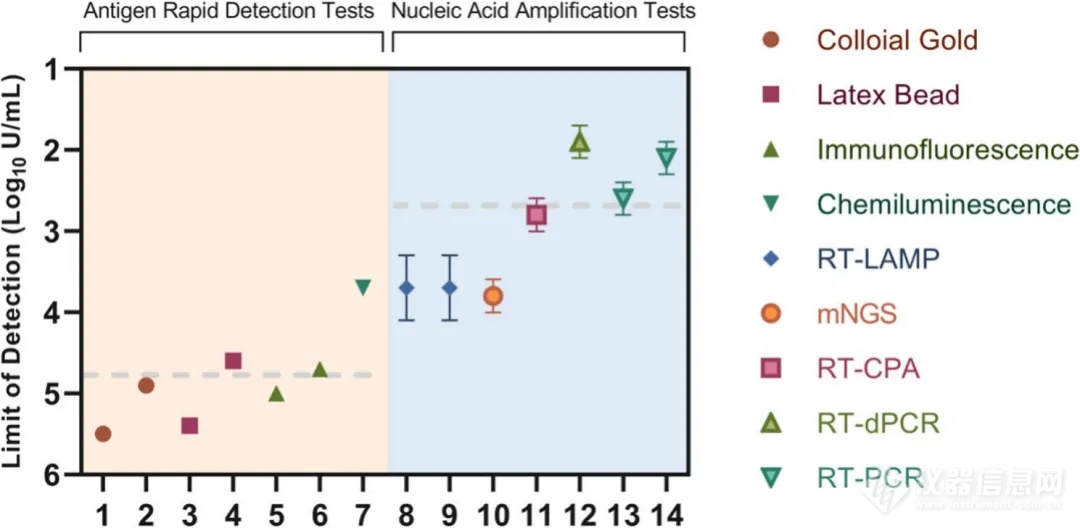
※ 检测限对比:核酸扩增检测更灵敏,部分特定方法的抗原检测接近“金标准”
总结与讨论
该研究建立的意义:
● 填补标准空白:首次建立新冠抗原和核酸通用标准品,为监管机构提供试剂审评和监管的统一依据,帮助企业优化产品性能(如标注“基于国标 U/mL 的 LoD”);
● 指导公共卫生决策:明确抗原快速检测与核酸扩增检测的灵敏度差异,为“高风险场景(如医院)用核酸扩增检测、大规模筛查用抗原快速检测”的策略提供数据支撑,尤其在变异株流行时(如Omicron),可通过及时研制变异株标准品快速评估试剂适用性;
● 技术可推广性:该基于dPCR的标准品建立思路,可延伸至流感、RSV等其他呼吸道病毒,为新发传染病早期检测标准化提供参考。
原文链接:
https://doi.org/10.1186/s12985-025-02954-w
●关于新羿生物●
新羿生物成立于2015年,位于中关村科技园,是国家高新技术企业、北京市“专精特新”企业,专注于生命科学与分子诊断的自主创新,拥有在仪器、芯片、材料、试剂、软件等领域的高水平研发团队。公司发展迅速,申请国内外专利200余项、授权专利150余项,持续在权威期刊发表学术论文,承担国家级科研基金。公司基于自主知识产权的数字PCR技术,已获得首个及第二个共三项数字PCR仪NMPA III类医疗器械注册证,三项诊断试剂NMPA III类医疗器械注册证,其中感染和实体瘤液体活检领域均为首个数字PCR诊断试剂III类注册证,两次获得中国体外诊断优秀创新产品金奖,荣获中关村国际前沿科技创新大赛总冠军,荣获北京市科学技术二等奖和发明创业成果奖。公司自主研发的开放式分子POCT一体机及qPCR快检试剂均获NMPA III类医疗器械注册证。公司秉承“创新,让精准触手可及”的理念,发展多指标、高通量、自动化、防污染、成本低的先进技术,致力于成为领先的生命科学和分子诊断企业,服务于生命科学、精准医疗、药物开发及健康管理。


京公网安备 11010802028168号